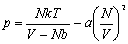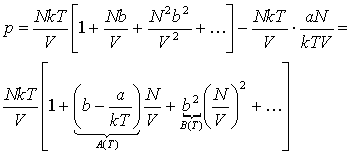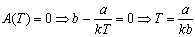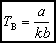idż do fizyka kwantowa. 2. Definicja i własności temperatury bezwzględnej; temperatura układów w równowadze cieplnej; pomiar temperatury. 3. Entropia (definicja mikroskopowa, małe przekazy ciepła); stan równowagi. 4. Układ kontaktujący się termicznie ze zbiornikiem ciepła (rozkład kanoniczny). 5. Paramagnetyzm (prawo Curie). Ciepło właściwe oscylatora harmonicznego. 6. Średnia energia i średnie ciśnienie gazu doskonałego. 7. Twierdzenie o wiriale w zastosowaniu do gazu doskonałego. Gazy rzeczywiste. 8. Ogólne równanie stanu gazów doskonałych. 9. Twierdzenie o ekwipartycji energii (wyprowadzenie i przykłady). 10. Maxwellowski rozkład prędkości. 11. Entropia gazu doskonałego; równanie adiabaty. 12. Zasady termodynamiki i związki statystyczne. Sprawność silnika. Cykl Carnota. 13. Potencjały termodynamiczne (wyprowadzenia) i tożsamości Maxwella. 14. Prawo Steana-Boltzmana. Prawo Wina. 15. Stan równowagi pomiędzy fazami; równanie Clausiusa - Clapeyrona. 16. Układy otwarte. Statystyki kwantowe. Granica klasyczna. 17. Rozkład Plancka. 18. Gęstość stanów w przestrzeniach 1, 2, 3-wymiarowych. Periodyczne a sztywne warunki brzegowe. 19. Gaz elektronów swobodnych. 20. Półprzewodniki: gęstość nośników, prawo działania mas, potencjał chemiczny. |
Opracowali: J. Ropka, B. Wróbel. Konsultacje: J. Wolny 7. Twierdzenie o wiriale w zastosowaniu do gazu doskonałego. Gazy rzeczywiste.Twierdzenie o wiriale.Powtórka dla pola grawitacyjnego:
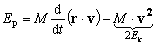 dla układów ograniczonych ta średnia wartość jest równa zeru (np. dla ruchu po okręgu iloczyn skalarny równy zero). Zatem: 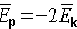 (dla stanów związanych energia potencjalna jest ujemna) (dla stanów związanych energia potencjalna jest ujemna)
Twierdzenie o wiriale dla gazu doskonałego.Rozpatrujemy cząsteczki jednoatomowe jednoatomowego gazu doskonałego.
dla trzech ścianek dostajemy wartość -3lF
Gazy rzeczywiste.Równanie stanu van der Waalsa jest wynikiem próby uwzględnienia w prosty jakościowy sposób wpływu oddziaływań cząsteczek w równaniu stanu gazu doskonałego. Występowanie twardego rdzenia w cząsteczce nie pozwala przeniknąć do pewnej objętości wokół niej innej cząsteczce. Jeśli V jest całkowitą objętością substancji, to efektywna objętość dostępna dla jej cząsteczek będzie mniejsza niż V o sumę objętości, do której cząsteczki nie mogą przeniknąć, czyli Vef=V=Nb, gdzie b jest stałą charakterystyczną dla rozważanej substancji, zależną od średnicy cząsteczek. Część przyciągająca energii potencjalnej przejawia się jakościowo w dążeniu do tworzenia stanu związanego. Przy dostatecznie silnym przyciąganiu układ byłby stanem związanym N ciał i niepotrzebne byłyby zewnętrzne ścianki do utrzymywania go. Dlatego możemy założyć, że przyciąganie prowadzi do zmniejszenia się ciśnienia, jakie układ wywiera na zewnętrzne ścianki. Zmniejszenie się ciśnienia jest proporcjonalne do liczby par cząsteczek znajdujących się przy ściankach w warstewce o grubości rzędu zasięgu oddziaływania. Liczba ta jest proporcjonalna do N2/V2. Ponieważ N i zasięg oddziaływania są stałe, to właściwe ciśnienie wynosi:
Równanie van der Waalsa ma postać:
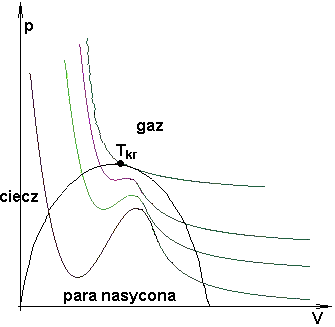
Dla danego T i p równanie van der Waalsa ma na ogół trzy pierwiastki zmiennej V. Ze wzrostem T pierwiastki te zbliżają się do siebie i dla T=Tkrzlewają się w punkcie Vkr. Stąd w otoczeniu punktu krytycznego równanie stanu musi mieć postać:
Gdyby mierzyć ciśnienie p w jednostkach pkr, T w jednostkach Tkr, V w jednostkach Vkr
Równanie to wyróżnia się tym, że nie zawiera żadnej stałej charakterystycznej substancji. Gdyby założenie van der Waalsa było poprawne, to powyższe równanie byłoby słuszne dla wszystkich substancji.
Twierdzenie, że równanie stanu wyrażone przez Rozwinięcie wirialne
He: TB = 17,5 K Ar: TB = 505,4 K O2: TB = 520,9 K H2O: TB = 2185 K góra |
||||||||||||||||||
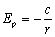
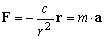
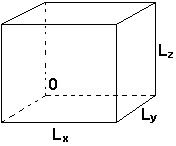
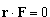 dla I, II, III
dla I, II, III
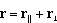 dla IV, V, VI
dla IV, V, VI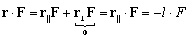
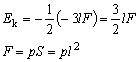
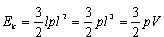
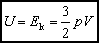
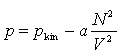
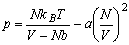
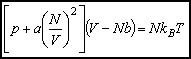
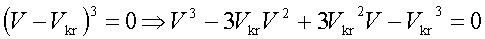
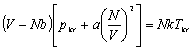
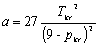
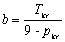
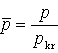
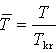
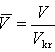
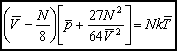
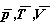 jest równaniem uniwersalnym dla wszystkich substancji, nazywa się prawem stanów odpowiadających sobie.
jest równaniem uniwersalnym dla wszystkich substancji, nazywa się prawem stanów odpowiadających sobie.