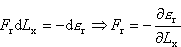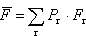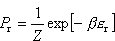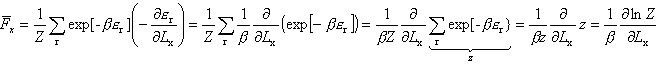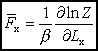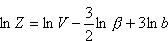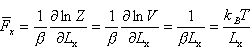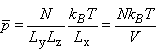idż do fizyka kwantowa. 2. Definicja i własności temperatury bezwzględnej; temperatura układów w równowadze cieplnej; pomiar temperatury. 3. Entropia (definicja mikroskopowa, małe przekazy ciepła); stan równowagi. 4. Układ kontaktujący się termicznie ze zbiornikiem ciepła (rozkład kanoniczny). 5. Paramagnetyzm (prawo Curie). Ciepło właściwe oscylatora harmonicznego. 6. Średnia energia i średnie ciśnienie gazu doskonałego. 7. Twierdzenie o wiriale w zastosowaniu do gazu doskonałego. Gazy rzeczywiste. 8. Ogólne równanie stanu gazów doskonałych. 9. Twierdzenie o ekwipartycji energii (wyprowadzenie i przykłady). 10. Maxwellowski rozkład prędkości. 11. Entropia gazu doskonałego; równanie adiabaty. 12. Zasady termodynamiki i związki statystyczne. Sprawność silnika. Cykl Carnota. 13. Potencjały termodynamiczne (wyprowadzenia) i tożsamości Maxwella. 14. Prawo Steana-Boltzmana. Prawo Wina. 15. Stan równowagi pomiędzy fazami; równanie Clausiusa - Clapeyrona. 16. Układy otwarte. Statystyki kwantowe. Granica klasyczna. 17. Rozkład Plancka. 18. Gęstość stanów w przestrzeniach 1, 2, 3-wymiarowych. Periodyczne a sztywne warunki brzegowe. 19. Gaz elektronów swobodnych. 20. Półprzewodniki: gęstość nośników, prawo działania mas, potencjał chemiczny. |
Opracowali: J. Ropka, B. Wróbel. Konsultacje: J. Wolny 6. Średnia energia i średnie ciśnienie gazu doskonałego.Obliczenia przeprowadzimy przy założeniach, że:
Powyższą funkcję rozdziału można przedstawić w postaci niezależnych iloczynów:
Pierwszy czynnik oznaczamy jako Zx
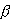 nie jest duże, czyli jest to słuszne dla wysokich temperatur). nie jest duże, czyli jest to słuszne dla wysokich temperatur).
A zatem kolejne wyrazy tej sumy będą się bardzo mało różnić, czyli z dużym przybliżeniem możemy ją zastąpić całką:
Ostatecznie dla gazu doskonałego w przybliżeniu klasycznym (tj. wysokich temperatur) otrzymujemy:
Średnie ciśnienie gazu doskonałego.
Oznaczmy przez F siłę, z jaką działa cząsteczka w kierunku x na prawą
ściankę pudła, w którym gaz jest zamknięty (tzn. ścianę x=Lx). Fr- wartość tej siły dla cząsteczki znajdującej się
w określonym stanie kwantowym r, w którym energia wynosi
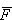 wywieraną przez cząsteczkę na ścianę naczynia otrzymamy uśredniając siłę Fr po wszystkich możliwych stanach cząsteczki wywieraną przez cząsteczkę na ścianę naczynia otrzymamy uśredniając siłę Fr po wszystkich możliwych stanach cząsteczki
Obliczamy średnie ciśnienie na ściankę naczynia dzieląc siłę przez powierzchnię S=LyLz
Jest to równanie stanu dla niezdegenerowanego gazu doskonałego góra |
||||||||||||||||||||||||||||||||||||||
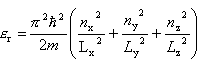
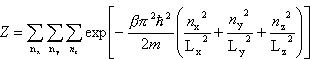
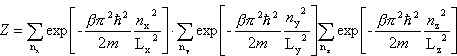
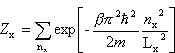
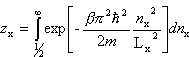
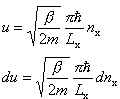
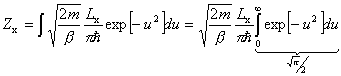
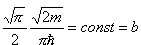
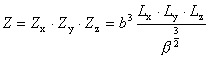
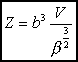
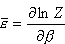
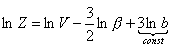
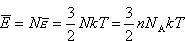
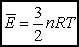
 r. Przypuśćmy, że przesunęlibyśmy
prawą ściankę zbiornika bardzo powoli w prawą stronę o odcinek dLx. W takim procesie praca, którą wykonałaby cząsteczka na tej ściance -
FrdLx musiałaby być równa ubytkowi energii -d
r. Przypuśćmy, że przesunęlibyśmy
prawą ściankę zbiornika bardzo powoli w prawą stronę o odcinek dLx. W takim procesie praca, którą wykonałaby cząsteczka na tej ściance -
FrdLx musiałaby być równa ubytkowi energii -d