idż do fizyka statystyczna.
1. Promieniowanie termiczne. Katastrofa w nadfiolecie.
2. Teoria Bohra układów wodoropodobnych.Doświadczenie Francka-Hertza.
3. Zjawisko fotoelektryczne. Wytwarzanie promieniowania rentgenowskiego.
4. Zjawisko Comptona.
5. Oddziaływanie promieniowania elektromagnetycznego z materią.
6. Fale de Broglie'a (własności, omówienie doświadczeń).
7. Postulaty fizyczne mechaniki kwantowej. Równanie Kleina - Gordona.
8. Mechanika falowa Schrödingera (operatory, postulaty).
9. Skok potencjału. Bariera potencjału. Zjawisko tunelowania.
10. Stany związane - nieskończona studnia potencjału.
11. Funkcje własne operatora pędu. Zasada nieoznaczoności.
12. Operator momentu pędu.
13. Równanie Schrödingera dla atomu wodoru; liczby kwantowe. Widma metali alkalicznych.
14. Orbitalny magnetyczny moment dipolowy. Precesja Larmora.
15. Oddziaływanie spin-orbita; sprzężenie L-S, j-j
16. Efekt Zeemana. Efekt Starka.
17. Konfiguracje elektronów w atomie. Reguły Hunda.
18. Liniowe widmo rentgenowskie. Prawo Moseley'a. Szerokość linii widmowej.
19. Atomy wieloelektronowe (helopodobne). Układ okresowy pierwiastków.
20. Molekuły dwuatomowe. Wiązania cząsteczkowe. Hybrydyzacja.
|
Notatki do wykładu z FIZYKI KWANTOWEJ.
Opracowali: J. Ropka, B. Wróbel.
Konsultacje: J. Wolny
13. Równanie Schrödingera dla atomu wodoru; liczby kwantowe. Widma metali alkalicznych.
Równanie Schrödingera dla atomu wodoru
Atom jednoelektronowy jest najprostszym układem związanym występującym w przyrodzie. Rozwiązanie równania Schrödingera dla atomu wodoru umożliwia wyznaczenie energii jego stanów stacjonarnych.
Atom wodoru składa się z protonu o masie M i elektronu o masie m, którego potencjał wynosi
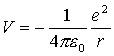 . .
Równanie Schrödingera dla atomu wodoru ma postać:
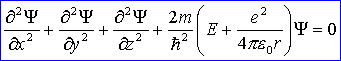
Klasyczne wyrażenie na energię ciała w polu sił centralnych możemy zapisać w postaci:
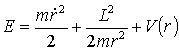
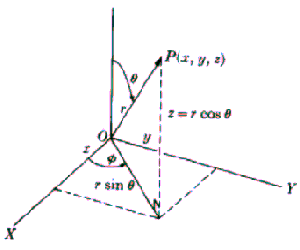
Zgodnie z zasadą odpowiedniości, stosowany operator energii wynosi (w układzie sferycznym):
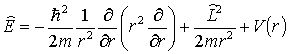
Energia zależy od kątów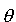 i
i
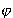 tylko poprzez tylko poprzez
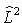 ,
więc stosując podstawienie na funkcje własne : ,
więc stosując podstawienie na funkcje własne :
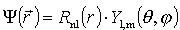
część radialna równania Schrödingera przyjmuje postać
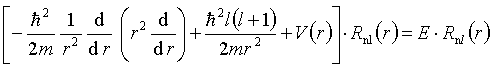
Pierwsze trzy funkcje radialne mają postać :
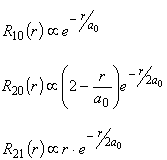
gdzie a0 jest promieniem pierwszej orbity Bohra (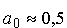 Å) Å) 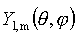 są
to funkcje kuliste zdefiniowane dla operatora kwadratu momentu pędu. są
to funkcje kuliste zdefiniowane dla operatora kwadratu momentu pędu.
Ostatecznie więc rozwiązania równania Schrödingera atomu wodoru opisane są trzema liczbami kwantowymi n, l, ml.
Przebieg funkcji radialnej R atomu wodoru dla niektórych n i l pokazano na rysunku:
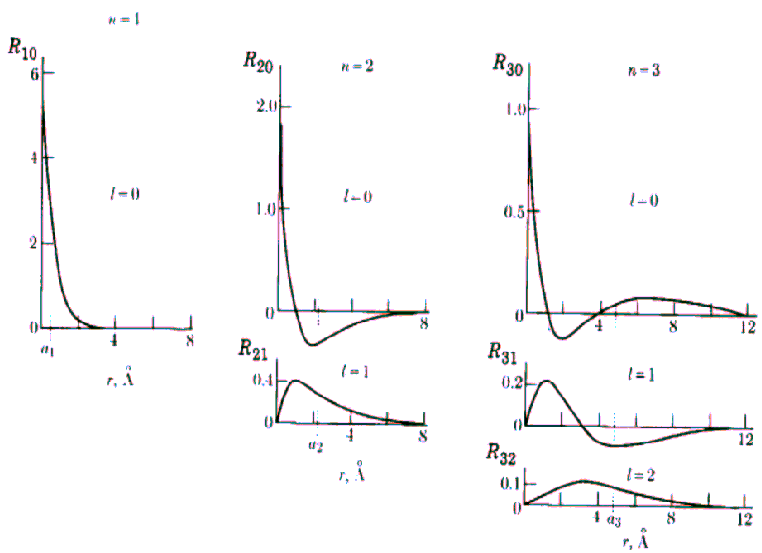
Rys. Część radialna funkcji falowych dla atomu wodoru (n = 1,2,3).
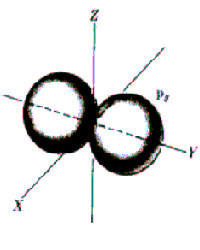
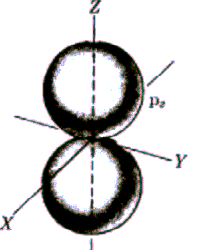
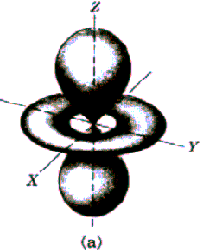
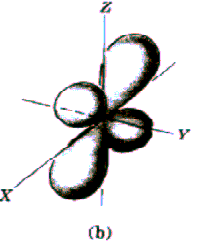
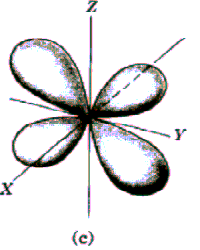
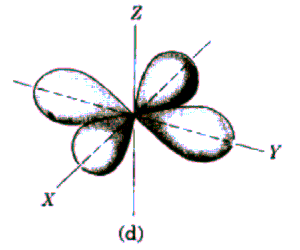
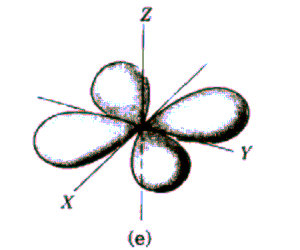
Widać, że dla dużych r wszystkie funkcje wykładniczo zmierzają do zera. Charakteryzują się one ponadto pewną liczbą miejsc zerowych równą n-l-1, którym na modelu przestrzennym odpowiadają sferyczne powierzchnie węzłowe.
Funkcja kątów również charakteryzuje się pewną liczbą powierzchni węzłowych, które w tym przypadku przechodzą przez początek układu, a ich liczba jest równa l. Tak więc ostatecznie liczba powierzchni węzłowych funkcji  jest równa n-l-1+l=n-1. jest równa n-l-1+l=n-1.
Sens fizyczny funkcji falowej  tkwi w tym, że
tkwi w tym, że 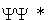 określa gęstość prawdopodobieństwa znalezienia cząstki w punkcie x. W
odniesieniu do atomu wodoru prawdopodobieństwo
określa gęstość prawdopodobieństwa znalezienia cząstki w punkcie x. W
odniesieniu do atomu wodoru prawdopodobieństwo 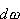 znalezienia elektronu w elemencie objętości
znalezienia elektronu w elemencie objętości
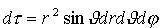 jest równe: jest równe:
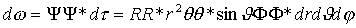
Przebieg
funkcji RR*(r) ilustruje zależność gęstości
prawdopodobieństwa znalezienia elektronu w odległości r od
jądra.
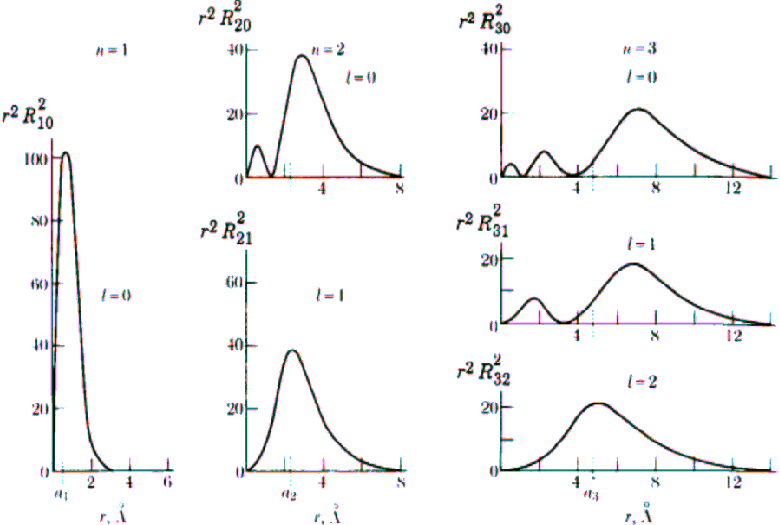
Rys. Część radialna rozkładów gęstości prawdopodobieństwa dla atomu wodoru (n = 1,2,3)
Z równania Schrödingera wynika, że w kwantowo-mechanicznym obrazie struktury atomu wodoru orbitom bohrowskim odpowiadają maksymalne wartości prawdopodobieństwa znalezienia elektronu. Natomiast istotna różnica pomiędzy kwantowo-mechanicznym obrazem struktury atomu wodoru a modelem Bohra-Sommerfelda polega na tym, że pierwszy z nich podaje określony rozkład prawdopodobieństwa znalezienia elektronu, które zeruje się jedynie na powierzchniach węzłowych, podczas gdy model Bohra określa ściśle zdefiniowane orbity elektronowe. O tak dokładnie określonych orbitach elektronowych na gruncie mechaniki kwantowej mówić nie możemy. Elektron wyobrażamy sobie w postaci rozmytej chmury, określonej przez gęstość prawdopodobieństwa znalezienia elektronu, o kształcie zależnym od liczb kwantowych opisujących dany stan atomu.
Rys. Część kątowa funkcji falowych dla stanów s, p i d
Liczby kwantowe
Chociaż wartości własne dla atomu jednoelektronowego zależą tylko od liczby kwantowej n, to jednak funkcje własne zależą od trzech liczb kwantowych n, l, ml. Fakt występowania trzech liczb kwantowych jest konsekwencją faktu, że niezależne od czasu równanie Schrödingera zawiera trzy zmienne niezależne; na każdą współrzędną przestrzenną przypada jedna liczba.
Ze względu na rolę, jaką liczba n odgrywa w określeniu całkowitej energii atomu, jest ona nazwana główną liczbą kwantową. Ponieważ orbitalny moment pędu zależy od l, liczbę tę nazywa się orbitalną liczbą kwantową, natomiast energia atomu w zewnętrznym polu magnetycznym zależy od ml,
więc liczbę tę nazwaną magnetyczną liczbą
kwantową. Przyjmują one wartości:
n = 1, 2, 3, ...
l = 0, 1, 2, ..., (n-1)
ml = -l, -l+1, ..., 0, ..., l-1, l
Dla danej wartości n istnieje na ogół kilka różnych możliwych wartości l oraz ml, co
pociąga za sobą istnienie kilku funkcji własnych dla tej samej
wartości własnej En. Zjawisko takie nosi nazwę
degeneracji, a o funkcjach mówi
się, że są zdegenerowane. Ilość zdegenerowanych funkcji własnych,
odpowiadających określonej wartości własnej En:
- dla każdej wartości n istnieje n dopuszczalnych wartości l,
- dla każdej wartości l istnieje 2l+1 dopuszczalnych wartości ml,
- dla każdej wartości n istnieje w sumie n2 zdegenerowanych funkcji własnych, co wynika z faktu, że
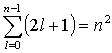
Jeśli atom znajdzie się w zewnętrznym polu magnetycznym, to jego energia
całkowita będzie zależeć od orientacji przestrzennej, którą określa
liczba kwantowa ml. Zatem, w zewnętrznym
polu magnetycznym degeneracja ze względu na ml
znika i atom ma różne poziomy energetyczne dla różnych wartości ml.
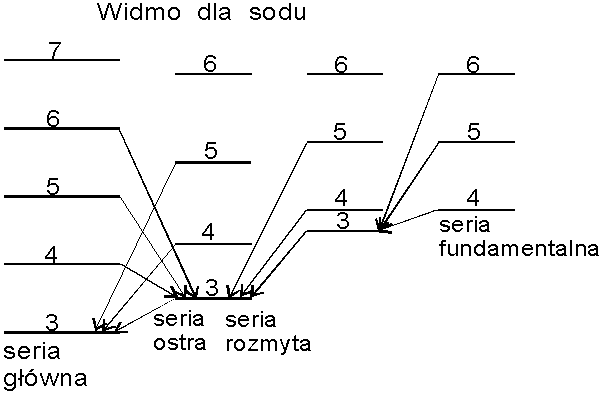
Widma metali alkalicznych.
Atomy metali alkalicznych składają się z rdzenia przypominającego atom
obojętnego chemicznie gazu szlachetnego i pojedynczego elektronu w
podpowłoce zewnętrznej. Analiza liniowego widma optycznego atomu
metalu alkalicznego na podstawie analizy stanów wzbudzonych tego
atomu jest dość prosta, ponieważ stany te można w pełni opisać
rozpatrując pojedynczy elektron, tzw. elektron
optycznie czynny, i pomijając zapełnione podpowłoki
rdzenia.
Zauważono,
że ogólny charakter widma absorpcyjnego par metali alkalicznych
przypomina prawidłowości charakteryzujące poszczególne serie
wodorowe. Wkrótce także i w emisyjnych widmach tych pierwiastków
wyodrębniono podobne serie linii widmowych, chociaż struktura seryjna
tych widm nie jest tak od razu widoczna, gdyż serie te częściowo na
siebie zachodzą.
Ze
względu na pewne specyficzne cechy poszczególnych serii widmowych
alkaliów, dla czterech najmocniejszych z nich przyjęły się nazwy:
seria główna ("principial" - "p"),
seria rozmyta ("diffuse" - "d"),
seria ostra ("sharp" - "s") , seria fundamentalna
("fundamental" - "f"). Seria
główna obejmuje
linie spektralne, które w niskich temperaturach są jedynymi liniami
występującymi w widmie absorpcyjnym każdego z omawianych
pierwiastków, z czego można od razu wnosić, że są one związane ze
stanami podstawowymi tych pierwiastków (są to linie rezonansowe);
nazwy "ostra" i "rozmyta" nawiązują do
zaobserwowanego charakteru linii należących do każdej z tych serii;
natomiast "fundamentalna" jest najmniej uzasadniona, a
może być nawet myląca, gdyż w rzeczywistości serii tej nie można
przypisać jakiegoś podstawowego znaczenia.
Badając szczegółowo prawidłowości
rozłożenia linii widmowych w czterech wymienionych seriach metali
alkalicznych Rydberg wykazał, że liczby falowe tych linii podlegają
tej samej zasadzie kombinacji, co w wodorze:
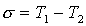
gdzie termy wyrażają się wzorem:
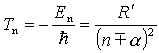
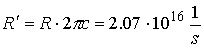
R - stała Rydberga!
n jest główną liczbą kwantową, a parametr 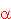 jest
tzw. defektem kwantowym. Dla sodu jest
tzw. defektem kwantowym. Dla sodu 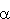 wynosi wynosi
(s) 1.35 (p) 0.87 (d) 0.01 (f) 0.00
Dla
każdej wartości n odchylenia wartości termów alkaliów od
odpowiednich termów wodorowych (a więc i wartości defektu kwantowego)
rosną w miarę wzrostu Z, a dla ustalonego pierwiastka maleją w
kolejności: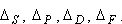
Ponieważ za wzbudzenie czy
jonizację atomu odpowiedzialny jest na ogół tylko jeden elektron
zewnętrzny, więc pod tym względem istnieje ścisła analogia do
sytuacji w atomie wodoru. Jednak zewnętrzny elektron atomu
alkalicznego znajduje się nie w prostym kulombowskim polu jądra, ale
w polu wywołanym przez jądro o ładunku Z i wewnętrzne
zamknięte powłoki elektronowe (Z-1), które ekranują pole jądra
od elektronu zewnętrznego. Okazuje się, że do takiego układu
składającego się z rdzenia i elektronu optycznego daje się zastosować
model zbliżony do modelu atomu wodoru.
Ze znalezionych doświadczalnie
wzorów wynika, że termy atomów metali alkalicznych o danej wartości n
są rozszczepione, a różnice energii między składowymi każdego termu
zależą od wartości defektów kwantowych. Ponieważ jednak
rozszczepienia te są tak znaczne, że nie można ich tłumaczyć efektami
relatywistycznymi, więc najwidoczniej spowodowane są one
oddziaływaniem elektronu optycznego z elektronami wewnętrznymi.
Rozpatrzmy
dwa skrajne przypadki (materiał nadobowiązkowy)
- Orbity
zanurzające się(*)
Jeżeli elektron optyczny
charakteryzuje się małą wartością k, to część tej orbity
przypadnie na obszar zajęty przez elektrony wewnętrzne atomu. Możemy
przyjąć, że w tym czasie, gdy elektron przebywa na zewnętrznej części
orbity zanurzającej się poruszać się będzie pod wpływem kulombowskiej
siły
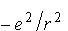 ,
a więc jego orbitą będzie elipsa (tak jak w przypadku wodoru). Z
chwilą jednak, gdy elektron znajdzie się wewnątrz rdzenia, działać
nań będzie siła znacznie większa. Spowoduje to silniejsze
przyciąganie jądro-elektron i zakrzywienie toru elektronu w kierunku
ku jądru. W rezultacie orbita elektronu optycznego nie będzie krzywą
zamkniętą, ale będzie miała kształt rozety. ,
a więc jego orbitą będzie elipsa (tak jak w przypadku wodoru). Z
chwilą jednak, gdy elektron znajdzie się wewnątrz rdzenia, działać
nań będzie siła znacznie większa. Spowoduje to silniejsze
przyciąganie jądro-elektron i zakrzywienie toru elektronu w kierunku
ku jądru. W rezultacie orbita elektronu optycznego nie będzie krzywą
zamkniętą, ale będzie miała kształt rozety.
Dzięki
temu, że przez pewien czas na elektron optyczny działa ładunek
większy od +e, średnia energia elektronu poruszającego się po
orbicie zanurzającej się będzie mniejsza od energii elektronu na
orbicie nie zniekształconej, a zatem poziom energetyczny takiego
układu w stosunku do poziomu wodorowego powinien być przesunięty ku
dołowi. Wielkość tego przesunięcia będzie tym większa im elektron
bardziej zbliży się do jądra, a więc im elipsa jest bardziej
wydłużona; największe odstępstwo od termów wodorowych wystąpi więc
wówczas, gdy kwantowa liczba azymutalna elektronu optycznego k=1.
Uwzględnienie
oddziaływania elektronu optycznego z elektronami wewnętrznymi atomu
pozwala wyjaśnić nie tylko rozszczepienie termu o danym n na
szereg składowych, ale także wzrost wartości tego rozszczepienia ze
wzrostem Z. Im więcej bowiem elektronów zawiera rdzeń atomu,
tym większe różnice energii w punkcie przyjądrowym i odjądrowym może
osiągnąć elektron poruszający się po takiej orbicie.
- Orbity niezanurzające się(*)
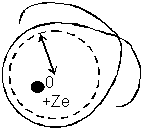
Z dokładnego porównania
wartości termów alkaliów z wartościami odpowiednich termów wodorowych
wynika, że istnieją między nimi pewne niewielkie nawet różnice w tych
wypadkach, gdy elektrony poruszają się po orbitach kołowych (n=k),
lub bardzo do nich zbliżonych. Ponieważ orbity tego typu na pewno
znajdują się na zewnątrz rdzenia, więc efektu tego nie da się
wytłumaczyć przenikaniem elektronu optycznego w głąb atomu.
Istnieje jednak jeszcze inny typ
oddziaływania elektronu optycznego z rdzeniem, którego dotąd nie
uwzględnialiśmy. Otóż nawet w przypadku, gdy elektron znajduje się na
zewnątrz rdzenia, pole elektrostatyczne działające nań nie jest
czysto kulombowskie, gdyż sam ten elektron powoduje polaryzację
rdzenia. Dzieje się to w ten sposób, że zewnętrzny elektron odpycha
od siebie ujemnie naładowaną chmurę elektronów wewnętrznych atomu, a
równocześnie przyciąga dodatnio naładowane jądro, na skutek czego
jądro i środek ciężkości elektronów wewnętrznych przesuwają się
względem siebie. W tej sytuacji pole pochodzące od rdzenia nie można
więc uważać za pole wywołane jedynie ładunkiem punktowym, gdyż w
rdzeniu powstaje indukowany dipol elektryczny. Pole tego dipola ma
symetrię osiową, która zniekształca sferyczną symetrię pola
wywołanego rdzeniem nieodkształconym. Przy obliczaniu więc energii
oddziaływania elektronu optycznego z polem rdzenia można traktować to
pole jako rezultat nałożenia się dwu pól. Rozwiązanie mechanicznego
problemu ruchu elektronu w takim polu przy założeniu, że pole osiowe
jest znacznie słabsze od kulombowskiego, wykazuje, że podobnie jak w
przypadku omawianych poprzednio orbit zanurzających się torem
elektronu optycznego jest elipsa wykonująca ruch precesyjny w swojej
płaszczyźnie. Prędkość kątowa tej precesji jest tym większa, im
większa jest wartość azymutalnej liczby kwantowej k.
Aby znaleźć widmo energetyczne
stacjonarnych stanów atomów metali alkalicznych można posłużyć się
równaniem Schrödingera, w którym energia potencjalna dana będzie
wzorem:
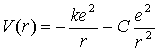
gdzie C jest stałą posiadającą wymiar długości i charakteryzującą wielkość
dipolowego momentu rdzenia.
| Zamiast l wstawiamy l': |
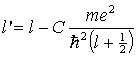 |
Dzięki takiemu podstawieniu możemy
skorzystać z rozwiązania części radialnej równania wodorowego, w
którym zamiast l należy wstawić l'. Otrzymamy
więc:
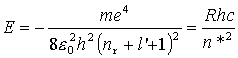
Ze wzoru definiującego liczbę l'
widać, że jest ona na ogół liczbą ułamkową. Powoduje to, że w wyrażeniu na energię stacjonarnego stanu atomu o jednym elektronie walencyjnym zamiast całkowitej liczby kwantowej: n = nr+l + 1, występuje liczba niecałkowita:
n* = nr + l' + 1,
która nazywana jest efektywną
liczbą kwantową. Można tę liczbę wyrazić za pomocą głównej
liczby kwantowej n, mianowicie:
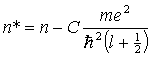
Porównując wzór na energię z empirycznym wyrażeniem dla termu widzimy, że n*=n - 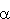 .
Mamy więc ostatecznie: .
Mamy więc ostatecznie:
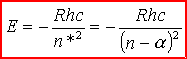
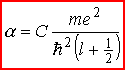
Ponieważ
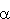 zależy od l, więc poziomy energetyczne
atomów metali
alkalicznych o tej samej głównej liczbie kwantowej n, ale
różnych wartościach l są - zgodnie z doświadczeniem -
rozszczepione. Każdej wartości liczby n odpowiada tyle różnych
stanów kwantowych (tyle różnych termów) ile różnych wartości
przyjmuje liczba kwantowa l, przy czym energia każdego z tych
stanów jest tym mniejsza (termy leżą tym niżej), im mniejsza jest
wartość liczby l elektronu optycznego. W powyższych wzorach
zawarta jest także zależność zależy od l, więc poziomy energetyczne
atomów metali
alkalicznych o tej samej głównej liczbie kwantowej n, ale
różnych wartościach l są - zgodnie z doświadczeniem -
rozszczepione. Każdej wartości liczby n odpowiada tyle różnych
stanów kwantowych (tyle różnych termów) ile różnych wartości
przyjmuje liczba kwantowa l, przy czym energia każdego z tych
stanów jest tym mniejsza (termy leżą tym niżej), im mniejsza jest
wartość liczby l elektronu optycznego. W powyższych wzorach
zawarta jest także zależność
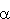 i En,l od liczby atomowej Z danego
atomu.
Mianowicie ze wzrostem Z rośnie wartość stałej C
odpowiedzialnej za moment dipolowy rdzenia, wobec czego defekt
kwantowy rośnie, a energia danego termu - maleje (term przesuwa
się ku dołowi). i En,l od liczby atomowej Z danego
atomu.
Mianowicie ze wzrostem Z rośnie wartość stałej C
odpowiedzialnej za moment dipolowy rdzenia, wobec czego defekt
kwantowy rośnie, a energia danego termu - maleje (term przesuwa
się ku dołowi).
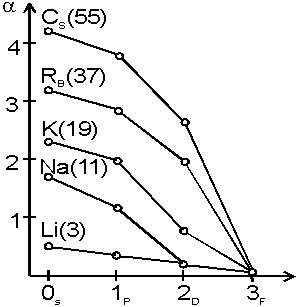
Dla porównania stosunków
energetycznych między termami wodorowymi i termami atomów metali
alkalicznych, na rysunku zostały zestawione diagramy poziomów
energetycznych H, Li i Na otrzymane na podstawie danych
doświadczalnych, przy czym poziomy odpowiadające stanom podstawowym
jonów H+, Li+ i Na+ narysowane
zostały na tej samej wysokości.
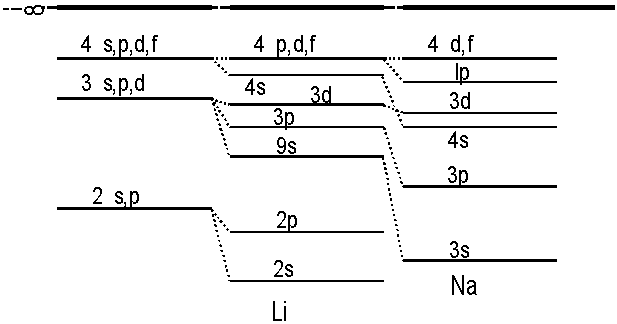
Przechodząc od H do Li i Na widzimy,
że rozszczepienie poziomów energetycznych odpowiadających tym samym
wartościom n i różnym l stopniowo wzrasta, a
równocześnie całość przesuwa się ku dołowi (całkowita energia
maleje).
Termy atomów metali alkalicznych można
także zapisać w nieco innej postaci niż to przedstawia wzór
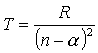 ,
który otrzymuje się w ten sposób, że do głównej liczby kwantowej
zwykłego termu wodorowego wprowadza się pewną poprawkę. Mianowicie
biorąc pod uwagę, że optyczny elektron atomu metali alkalicznych
porusza się w polu jądra o ładunku +Ze zaburzonym pozostałymi
elektronami, można poprawki odpowiedzialne za różnice między termami
atomów alkaliów a wodorowymi odnieść do ładunku jądra wprowadzając do
termu wodorowego tzw. efektywny ładunek
jądra określony wzorem: ,
który otrzymuje się w ten sposób, że do głównej liczby kwantowej
zwykłego termu wodorowego wprowadza się pewną poprawkę. Mianowicie
biorąc pod uwagę, że optyczny elektron atomu metali alkalicznych
porusza się w polu jądra o ładunku +Ze zaburzonym pozostałymi
elektronami, można poprawki odpowiedzialne za różnice między termami
atomów alkaliów a wodorowymi odnieść do ładunku jądra wprowadzając do
termu wodorowego tzw. efektywny ładunek
jądra określony wzorem:
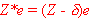
We wzorze tym Z jest liczbą
atomową danego pierwiastka, a 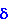 nosi nazwę stałej ekranowania,
gdyż wskazuje ona w jakim stopniu działanie ładunku jądra na elektron
optyczny zostaje skompensowane przez pozostałe elektrony.
nosi nazwę stałej ekranowania,
gdyż wskazuje ona w jakim stopniu działanie ładunku jądra na elektron
optyczny zostaje skompensowane przez pozostałe elektrony.
A zatem
na termy alkaliów otrzymujemy wzór:

gdzie n jest główną liczbą
kwantową. Tak wprowadzona poprawka do termów wodorowych ma bardziej
określony sens fizyczny, gdyż efektywny ładunek jądra Z*e
oznacza po prostu ładunek faktycznie działający na elektron optyczny.
góra
|
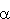 wynosi
wynosi
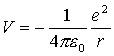 .
.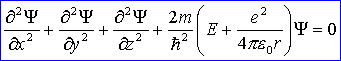
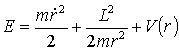
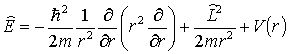
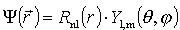
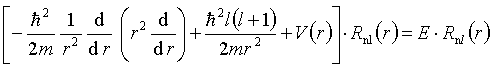
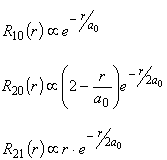
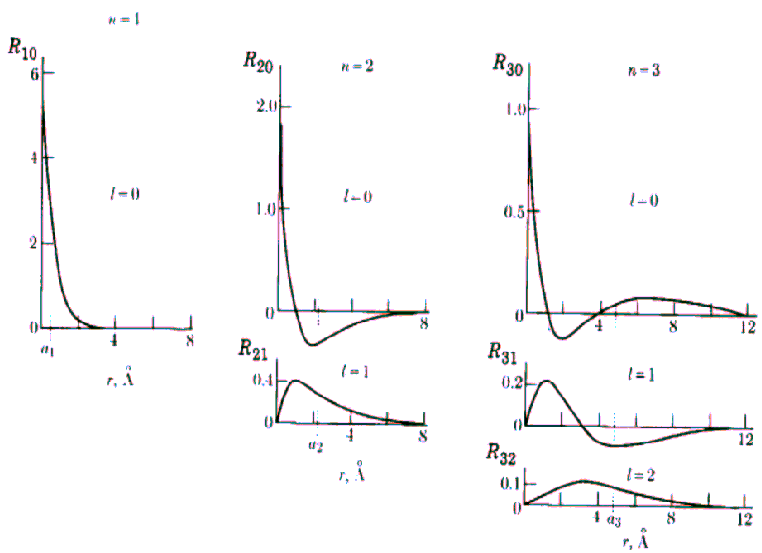
 jest równa n-l-1+l=n-1.
jest równa n-l-1+l=n-1.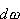 znalezienia elektronu w elemencie objętości
znalezienia elektronu w elemencie objętości
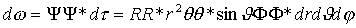

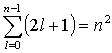
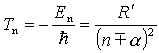

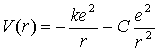
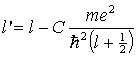
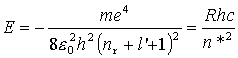
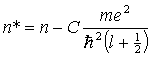
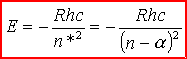
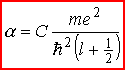
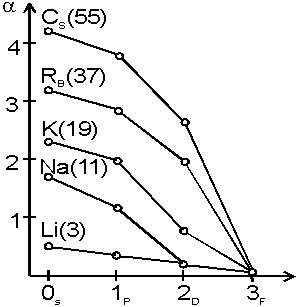

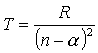 ,
który otrzymuje się w ten sposób, że do głównej liczby kwantowej
zwykłego termu wodorowego wprowadza się pewną poprawkę. Mianowicie
biorąc pod uwagę, że optyczny elektron atomu metali alkalicznych
porusza się w polu jądra o ładunku +Ze zaburzonym pozostałymi
elektronami, można poprawki odpowiedzialne za różnice między termami
atomów alkaliów a wodorowymi odnieść do ładunku jądra wprowadzając do
termu wodorowego tzw. efektywny ładunek
jądra określony wzorem:
,
który otrzymuje się w ten sposób, że do głównej liczby kwantowej
zwykłego termu wodorowego wprowadza się pewną poprawkę. Mianowicie
biorąc pod uwagę, że optyczny elektron atomu metali alkalicznych
porusza się w polu jądra o ładunku +Ze zaburzonym pozostałymi
elektronami, można poprawki odpowiedzialne za różnice między termami
atomów alkaliów a wodorowymi odnieść do ładunku jądra wprowadzając do
termu wodorowego tzw. efektywny ładunek
jądra określony wzorem:

