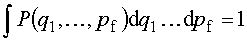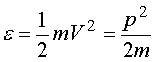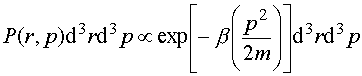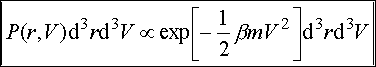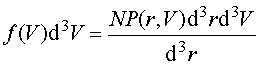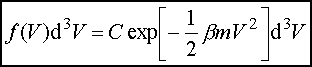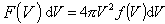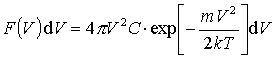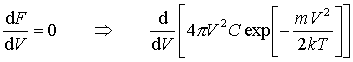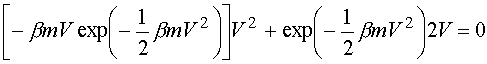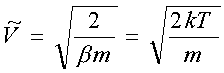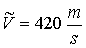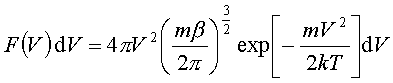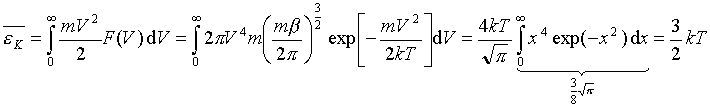idż do fizyka kwantowa. 2. Definicja i własności temperatury bezwzględnej; temperatura układów w równowadze cieplnej; pomiar temperatury. 3. Entropia (definicja mikroskopowa, małe przekazy ciepła); stan równowagi. 4. Układ kontaktujący się termicznie ze zbiornikiem ciepła (rozkład kanoniczny). 5. Paramagnetyzm (prawo Curie). Ciepło właściwe oscylatora harmonicznego. 6. Średnia energia i średnie ciśnienie gazu doskonałego. 7. Twierdzenie o wiriale w zastosowaniu do gazu doskonałego. Gazy rzeczywiste. 8. Ogólne równanie stanu gazów doskonałych. 9. Twierdzenie o ekwipartycji energii (wyprowadzenie i przykłady). 10. Maxwellowski rozkład prędkości. 11. Entropia gazu doskonałego; równanie adiabaty. 12. Zasady termodynamiki i związki statystyczne. Sprawność silnika. Cykl Carnota. 13. Potencjały termodynamiczne (wyprowadzenia) i tożsamości Maxwella. 14. Prawo Steana-Boltzmana. Prawo Wina. 15. Stan równowagi pomiędzy fazami; równanie Clausiusa - Clapeyrona. 16. Układy otwarte. Statystyki kwantowe. Granica klasyczna. 17. Rozkład Plancka. 18. Gęstość stanów w przestrzeniach 1, 2, 3-wymiarowych. Periodyczne a sztywne warunki brzegowe. 19. Gaz elektronów swobodnych. 20. Półprzewodniki: gęstość nośników, prawo działania mas, potencjał chemiczny. |
Opracowali: J. Ropka, B. Wróbel. Konsultacje: J. Wolny 10. Maxwellowski rozkład prędkości.Przestrzeń fazowa.
Do pełnego opisu układu potrzebna jest w mechanice klasycznej znajomość współrzędnych uogólnionych (q) i pędów uogólnionych (p). Przestrzeń, która jest zbudowana na tych współrzędnych i pędach, to przestrzeń fazowa.
Maxwellowski rozkład prędkości.Rozważamy gaz w stanie równowagi. Jaki jest rozkład prędkości cząsteczek takiego gazu? Załóżmy, że w naszych warunkach dozwolony jest klasyczny opis cząsteczek gazu i zajmijmy się szczegółowiej dowolną jednoatomową jego cząsteczką. Taka cząsteczka przedstawia dla nas niewielki, wyróżniony układ znajdujący się w kontakcie termicznym ze zbiornikiem ciepła złożonym z pozostałych cząsteczek gazu i mającym temperaturę T. W przypadku, gdy można zaniedbać siły zewnętrzne, energia naszej cząsteczki jest po prostu jej energią kinetyczną
Można zapytać, ile cząsteczek ma prędkość w określonym przedziale prędkości.
Ponieważ N cząsteczek gazu porusza się niezależnie, prawie nie oddziałując na siebie, więc gaz ten przedstawia statystyczny zbiór cząsteczek, z których pewien ułamek określany prawdopodobieństwem P(r, V) znajduje się pomiędzy r i r+dr, a prędkość pomiędzy V i V+dV. Średnia liczba f(V)d3V jest zatem równa iloczynowi prawdopodobieństwa P(r, V)d3rd3V i całkowitej liczby cząsteczek N podzielonemu przez element objętości d3r. Zatem
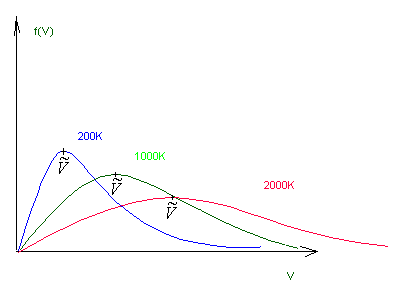
Równanie to nosi nazwę maxwellowskiego rozkładu prędkości. Zauważmy, że ani prawdopodobieństwo P(r, V), ani też średnia liczba f nie zależą od położenia r cząsteczki, ponieważ nie może mieć ona uprzywilejowanego położenia w przestrzeni, w przypadku gdy na układ nie działają żadne siły zewnętrzne. P(r, V) zależy tylko od modułu wektora V, a nie zależy od kierunku.
Rozkład szybkości.F(V)dV - średnia liczba cząsteczek na jednostkę objętości, których szybkość |V| znajduje się pomiędzy V i V+dV
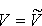 odpowiadającą maksimum rozkładu F(V)nosi nazwę najbardziej prawdopodobnej szybkości. Można ją znaleźć przyrównując do zera pochodną: odpowiadającą maksimum rozkładu F(V)nosi nazwę najbardziej prawdopodobnej szybkości. Można ją znaleźć przyrównując do zera pochodną:
|
||||||||||
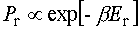
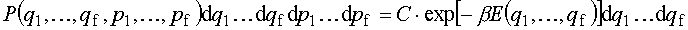 ;
;