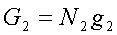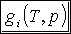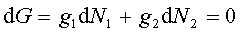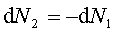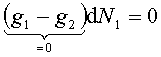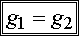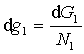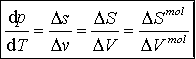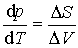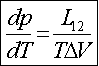idż do fizyka kwantowa. 2. Definicja i własności temperatury bezwzględnej; temperatura układów w równowadze cieplnej; pomiar temperatury. 3. Entropia (definicja mikroskopowa, małe przekazy ciepła); stan równowagi. 4. Układ kontaktujący się termicznie ze zbiornikiem ciepła (rozkład kanoniczny). 5. Paramagnetyzm (prawo Curie). Ciepło właściwe oscylatora harmonicznego. 6. Średnia energia i średnie ciśnienie gazu doskonałego. 7. Twierdzenie o wiriale w zastosowaniu do gazu doskonałego. Gazy rzeczywiste. 8. Ogólne równanie stanu gazów doskonałych. 9. Twierdzenie o ekwipartycji energii (wyprowadzenie i przykłady). 10. Maxwellowski rozkład prędkości. 11. Entropia gazu doskonałego; równanie adiabaty. 12. Zasady termodynamiki i związki statystyczne. Sprawność silnika. Cykl Carnota. 13. Potencjały termodynamiczne (wyprowadzenia) i tożsamości Maxwella. 14. Prawo Steana-Boltzmana. Prawo Wina. 15. Stan równowagi pomiędzy fazami; równanie Clausiusa - Clapeyrona. 16. Układy otwarte. Statystyki kwantowe. Granica klasyczna. 17. Rozkład Plancka. 18. Gęstość stanów w przestrzeniach 1, 2, 3-wymiarowych. Periodyczne a sztywne warunki brzegowe. 19. Gaz elektronów swobodnych. 20. Półprzewodniki: gęstość nośników, prawo działania mas, potencjał chemiczny. |
Opracowali: J. Ropka, B. Wróbel. Konsultacje: J. Wolny 15. Stan równowagi pomiędzy fazami; równanie Clausiusa - Clapeyrona.
Oznaczamy przez N1 liczbę cząsteczek substancji znajdujących się w fazie 1, a przez N2 liczbę cząsteczek substancji znajdujących się w postaci odpowiadającej fazie 2.
G=N1g1+N2g2
Jeżeli obie fazy współistnieją w stanie równowagi, wartości N1 i N2 muszą
być takie, by G było minimalne. Więc G musi pozostać stałe
dla nieskończenie małych zmian N1 i N2 ,
a więc
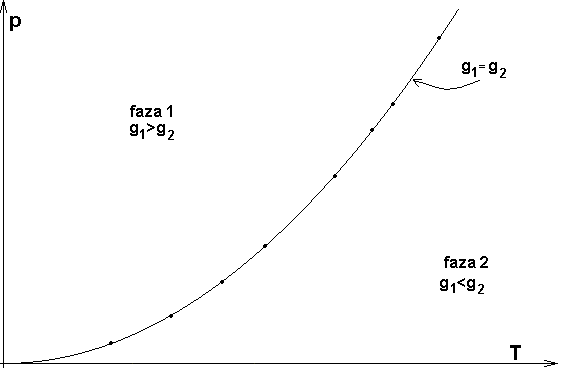
Jeżeli T i p są takie, że g1 < g2, to G ma minimalną wartość, o ile wszystkie cząsteczki substancji znajdują się w fazie 1, tak że G=Ng1. Wtedy w stanie równowagi może istnieć tylko faza 1. Jeżeli T i p są takie, że g1 > g2 , to G ma wartość min., gdy wszystkie cząsteczki substancji są w fazie 2, tak że G=Ng2. Wtedy tylko faza 2 może istnieć w stanie równowagi. Natomiast, jeżeli T i p mają takie wartości, że g1 = g2 , dowolna liczba N1 cząsteczek fazy 1 może współistnieć w stanie równowagi z N2 cząsteczkami.
Równanie Clausiusa-Clapeyrona
Na przykład: dla danej przemiany mierząc zależność temperatury przemiany od ciśnienia mo-żemy określić ciepło przemiany. góra |
|||||||||||||||||||||||||||
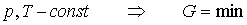
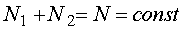
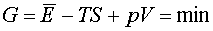
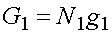 i
i